Le Zona chez le sujet âgé
Épidémiologie
Le virus de la varicelle et du zona (VZV) est responsable de la varicelle puis par réactivation tardive du zona. Le zona est une éruption cutanée classiquement métamérique qui confronte les patients à des douleurs aiguës et des complications dont la plus éprouvante et invalidante est la névralgie post-zostérienne (NPZ). Les antiviraux réduisent la sévérité de l’éruption. Leur effet préventif et antalgique reste par contre modeste sur la NPZ dont le traitement doit être particulièrement prudent chez les plus âgés. La disponibilité d’un vaccin efficace et bien toléré est une réelle avancée en matière de santé publique.
En France, l’incidence annuelle est estimée entre 3,2 et 4,8 cas/1 000 personnes dans la population générale (selon réseau « Sentinelles »). Après 60 ans, l’incidence est par contre multipliée par un facteur 8 à 10 par comparaison à celle observée chez les adultes plus jeunes. Cela est expliqué à la fois par (1) la diminution de l’immunité cellulaire spécifique post varicelle contre le VZV avec le temps ; (2) le vieillissement du système immunitaire (ou immunosénescence) ; (3) l’augmentation de la susceptibilité à développer avec l’âge des pathologies infectieuses, tumorales et auto-immunes ; et (4) l’augmentation du recours aux thérapeutiques immunosuppressives. Si l’avancée en âge est un facteur de risque bien établi, le sexe, l’origine ethnique, certaines susceptibilités génétiques, les traumatismes physiques et/ou psychologiques en sont d’autres, plus controversés. Le zona aigu et la névralgie post-zostérienne (NPZ) peuvent affecter de manière significative la qualité de vie des patients, en raison des douleurs induites et des troubles du sommeil et de l’humeur associés. Cet impact est très fortement lié à la sévérité, la durée et l’inconfort des douleurs aiguës et/ou la NPZ. Si dans la population générale, en moyenne la NPZ complique 5 % des cas de zona, l’incidence de cette complication s’élève à 10 % entre 60 et 69 ans, et à 20 % après 80 ans. Dans 50 % des cas, la NPZ peut perdurer au-delà de 12 mois.
Pathogénie
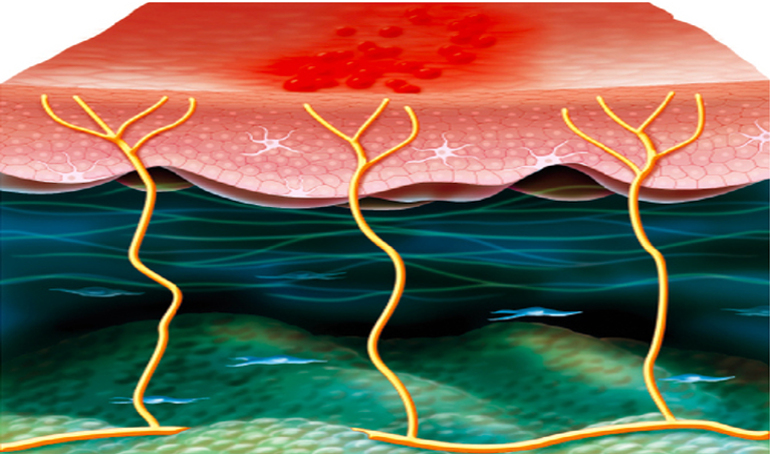
Le zona résulte de la réactivation du VZV au sein des ganglions sensitifs latéraux vertébraux des nerfs crâniens ou spinaux après une période de latence de plusieurs décennies au décours de la résolution d’une primo-infection (la varicelle). La latence constitue une caractéristique particulière de tous les herpès virus leur permettant de prévenir leur élimination complète suite à la première infection. Il est tentant de penser que la capacité du virus à établir une infection latente a constitué, au cours de l’évolution, un atout majeur, assurant sa subsistance et sa propagation au sein des communautés. Le VZV ne se réactive en théorie, de manière symptomatique, qu’une seule fois au cours de la vie. Il fait cependant très probablement l’objet de réactivations subcliniques périodiques difficilement détectables et plus rarement de réels épisodes de zona récidivant. Le zona, qui survient généralement dans un contexte de « déficit immunitaire », est plus fréquent chez les personnes âgées ou dans des situations pathologiques affectant le statut immunitaire. Les particules virales infectieuses produites lors de la réactivation regagnent la peau via le flux axonal antérograde en générant une mono-névrite aiguë. Elles y provoquent des lésions cutanées synchrones et localisées au dermatome du territoire d’innervation du ganglion dans lequel le virus s’est réactivé. Chez les individus immunodéprimés, principalement parce que le virus est inefficacement contrôlé par le système immunitaire, les lésions ne sont généralement pas limitées anatomiquement et l’infection peut se disséminer et infecter plusieurs métamères, voire conduire à une infection poly-viscérale. Une extension au système nerveux central via le cordon postérieur de la moelle et les leptoméninges est également possible.
À la fin de la phase aiguë, les phénomènes de cicatrisation conduisent au niveau de la corne postérieure de la moelle à une atrophie cellulaire et axonale ainsi qu’à une fibrose du ganglion et/ou de sa racine postérieure. La douleur associée à la phase aiguë apparaît ainsi à la fois induite par l’inflammation associée à la migration des particules virales et la destruction des structures nerveuses. En réponse aux destructions tissulaires, le seuil de sensibilité du premier neurone afférent de la corne dorsale est modifié, induisant une stimulation en l’absence de stimulus. Ce phénomène de « re-sensing » est une explication de l’apparition des NPZ.
Si les recherches menées ont permis de faire d’améliorer la compréhension de la biologie du VZV, nombreuses sont encore les inconnues. Les mécanismes régissant l’établissement et le maintien de la latence, le(s) processus de réactivation ou encore les interactions directes entretenues entre le virus et son hôte restent encore à comprendre.
L’histoire naturelle
• Le zona typique
Les premiers symptômes sont le plus souvent une sensation de malaise général, une douleur et/ou une hypo- ou une hyperesthésie cutanée du dermatome affecté. Certains patients décrivent des sensations de brûlure, de démangeaisons, des douleurs lancinantes ou des dysesthésies. Près de trois-quarts des patients décrivent des douleurs prodromales dans le(s) dermatome(s) concerné(s), si bien que ces patients peuvent être souvent traités pour d’autres affections (sciatique, cholécystite, etc.) avant l’apparition des premières vésicules caractéristiques. Les dermatomes thoraciques (particulièrement Th4 à Th6), cervicaux et trigéminés sont les plus souvent concernés. L’éruption apparaît dans les trois à quatre jours suivants. Classiquement, les lésions initialement vésiculeuses ou bulleuses se transforment en pustules puis prennent un aspect hémorragique en 3 à 4 jours. Lorsque les lésions deviennent croûteuses (7 à 10 jours), la contagiosité par contact est nulle. Les croûtes persistent 3 à 4 semaines et cicatrisent en prenant parfois un aspect hypo- ou hyper-pigmenté. Comme lors de la varicelle, il est possible que plusieurs vagues d’éruption surviennent, donnant lieu à des lésions d’âges différents. Bien que les douleurs aiguës soient plus fréquemment décrites dans la population âgée, elles peuvent être totalement absentes. Présentes, elles sont alors décrites comme des expériences très pénibles générant des troubles du sommeil, parfois une anorexie, une perte d’autonomie fonctionnelle et/ou une confusion, notamment chez les patients âgés et les plus fragiles. La douleur associée à l’éruption est aiguë en « coup de poignard », alors qu’une sensation de brûlures est le plus souvent associée aux NPZ. L’allodynie est décrite chez plus de 90 % des patients avec NPZ ; une hypo ou anesthésie, touchant aussi bien la sensibilité thermique, tactile, ou vibratoire a également été décrite. Le trouble sensitif peut également s’étendre au-delà des limites métamériques.
• Les formes atypiques
Elles sont le plus souvent décrites chez des patients immunosupprimés. Les lésions cutanées ont souvent une évolution prolongée, intermittente et/ou récurrente, affectant plusieurs dermatomes. Des formes croûteuses ou verruqueuses et/ou pauci-vésiculaires sont également décrites. Les atteintes extensives avec lésion(s) viscérale(s) ont surtout été observées chez les transplantés, durant une chimiothérapie ou chez des personnes infectées par le VIH.
Si la littérature souligne le lien étroit avec l’immunosuppression liée aux néoplasies, aux hémopathies et à l’infection par le VIH, la survenue d’un zona ne doit pas pour autant être considérée comme le signal d’une maladie occulte à rechercher activement. La réalisation d’une sérologie pour le HIV n’est recommandée que chez des sujets à risque d’infection par ce virus. Dans les formes atypiques, notamment peu douloureuses et/ou avec une éruption très limitée, une infection à Herpes simplex ou une dermite de contact doivent être évoquées comme des diagnostiques différentiels.
Des zonas sans lésions (Herpès sine zoster) ont été décrits. Il s’agit de patients présentant des douleurs bien systématisées selon un dermatome mais sans apparition de lésions cutanées. Dans ces situations, de l’ADN viral du VZV a été retrouvé dans le liquide cérébrospinal et dans les cellules mononucléées sanguines. Cependant, des études complémentaires, bien documentées sur le plan virologique, sont encore nécessaires pour mieux préciser cette forme clinique et en déterminer la fréquence.
Diagnostic
L’aspect des lésions et la localisation sont le plus souvent suffisants pour poser le diagnostic. Ainsi, (1) une sensation douloureuse ou un prodrome sensitif (pas toujours présent) ; (2) respectant un dermatome ; (3) suivi d’une éruption de vésicules groupées (cependant, dans certains cas, seule une papule peut être observée) ; (4) en l’absence d’éruption identique dans le(s) même(s) dermatome(s) (pour exclure une récurrence à Herpes simplex) ; (5) associées à une douleur et/ou une allodynie dans le territoire de l’éruption, sont les caractéristiques pathognomoniques du zona. Le recours aux examens de laboratoire devrait se limiter aux formes atypiques et/ou graves, ainsi qu’aux patients immunosupprimés.
• Diagnostic indirect
Le cytodiagnostic de Tzanck et l’histologie cutanée mettent en évidence l’effet cytopathogène du virus, mais ne permettent pas de différencier une infection par les VZV d’une infection par un herpès simplex. Le cytodiagnostic de Tzanck, par frottis, est un examen simple et rapide qui met en évidence une altération des kératinocytes traduite par un gonflement de leurs cytoplasmes qui devient clair homogénéisé entourant un noyau monstrueux (dégénérescence ballonisante). L’histologie d’une vésicule montre des vésicules intra-épidermiques, des kératinocytes ballonisés qui flottent dans la sérosité dans la vésicule, les kératinocytes altérés sont le siège d’inclusions intranucléaires et sont associés à des cellules multinuclées géantes. Un infiltrat leucocytaire polymorphe est présent dans le derme.
• Diagnostic virologique
La culture virale est-elle très sensible, mais son résultat est tardif (1-2 semaines) et le rendement médiocre en raison de l’instabilité du VZV (détection sur 60 % à 75 % des échantillons). Un prélèvement riche en virus, inoculé au lit du malade ou transporté immédiatement en milieu de transport pour virus au laboratoire est nécessaire. Les prélèvements les plus intéressants sont la ponction du liquide vésiculaire et l’écouvillonnage du plancher de la vésicule. Le VZV peut également être détecté dans le liquide céphalorachidien, dans le sang chez l’immunodéprimé et dans les biopsies. L’isolement se fait uniquement en cultures cellulaires. L’identification repose sur la mise en évidence d’antigènes en 48 heures ou d’un effet cytopathique qui apparaît en 3 à 12 jours.
Le VZV peut être mis en évidence directement par immunofluorescence grâce à des anticorps monoclonaux ou polyclonaux sur le frottis des lésions cutanées. L’immuno-histochimie a l’avantage du coût et d’un résultat en moins de 3 heures. C’est une technique très spécifique (95 %) mais relativement peu sensible (90 %) qui dépend fortement de la fraîcheur du prélèvement et du nombre de cellules analysées. Alors que la sensibilité de l’immuno-histochimie s’effondre avec le vieillissement des lésions, elle est inutile, tout comme la culture virale, à la phase croûteuse. De façon comparable, la culture et l’immuno-histochimie permettent de distinguer les infections à VZV des autres herpes virus.
La PCR est l’examen de référence, mais également le plus couteux. L’analyse de l’ADN, qui nécessite au moins une journée, est très utile pour mettre en évidence de faibles quantités d’ADN viral au niveau du liquide des vésicules, dans les cellules mononuclées du sang périphérique mais aussi à partir de prélèvements faits sur des lésions anciennes et/ou croûteuses. Sa sensibilité dépasse celle des cultures et de la détection de l’antigène sur lame et nécessite peu de matériel de prélèvement.
La sérologie a un intérêt limité pour le diagnostic. Elle montrerait une augmentation significative des immunoglobulines (Ig) G spécifiques, avec ou sans réactivation IgM. Son intérêt réside surtout dans la détermination du statut immunitaire d’un patient devant un risque d’infection grave (IgG négative).
Les complications
Les complications les plus fréquemment décrites sont les NPZ, les atteintes oculaires, neurologiques et les surinfections cutanées. Dans une revue de 859 patients atteints de zona, 12 % ont présenté 123 complications dans les 60 jours suivant l’éruption éruptive (83 % ont développé une complication, 12 % deux et 5 % trois ou plus). Les complications étaient bien plus fréquentes après 65 ans, le risque relatif de survenue étant 8 fois supérieur à celui observé chez les adultes plus jeunes.
• La névralgie post-zostérienne (NPZ)
Les douleurs zostériennes sont généralement classées en deux catégories selon le moment de leur apparition et leur durée par rapport à l’éruption. Les douleurs aiguës sont définies comme celles précédant et/ou accompagnant les vésicules et dont la durée n’excède pas 30 jours. Au-delà, toute douleur doit être considérée comme une NPZ. Les principaux facteurs de risque sont, hormis l’âge, l’intensité des symptômes douloureux à la phase aiguë, la sévérité de l’éruption et la présence de douleurs prodromiques. Ces patients présentent alors, dans 50 à 75 % des cas, des douleurs plus de 6 mois après le début de l’éruption.
• Le zona ophtalmique
 Les formes ophtalmiques compliquent 10 à 15 % des zonas avec un âge moyen de survenue supérieur à 50 ans. Mettant en jeu le pronostic visuel, elles sont consécutives à la réactivation du VZV dans le ganglion de Gasser. La branche frontale du nerf ophtalmique, est parmi les trois branches de division la plus fréquemment concernée ; 50 à 71 % des zonas ophtalmiques se compliquent d’une atteinte oculaire. Les lésions cutanées sont, classiquement, unilatérales, présentes sur le front, la région périorbitaire et le nez, correspondant au dermatome de la racine frontale de la première branche de division du nerf trijumeau. La douleur est, elle aussi, unilatérale. Deux tiers des sujets présentent des lésions cornéennes ponctiformes et/ou dendritiques. Un diagnostic rapide est impératif afin de limiter l’atteinte cornéenne et préserver la fonction visuelle. L’approche habituellement recommandée est l’initiation d’un traitement antiviral systémique afin de limiter la réplication virale ; des corticostéroïdes topiques sont conseillés afin de limiter la réponse inflammatoire et de contrôler la kératite et l’iritis. Cette approche permet de réduire la fréquence des complications ophtalmologiques de 50 à 20 %.
Les formes ophtalmiques compliquent 10 à 15 % des zonas avec un âge moyen de survenue supérieur à 50 ans. Mettant en jeu le pronostic visuel, elles sont consécutives à la réactivation du VZV dans le ganglion de Gasser. La branche frontale du nerf ophtalmique, est parmi les trois branches de division la plus fréquemment concernée ; 50 à 71 % des zonas ophtalmiques se compliquent d’une atteinte oculaire. Les lésions cutanées sont, classiquement, unilatérales, présentes sur le front, la région périorbitaire et le nez, correspondant au dermatome de la racine frontale de la première branche de division du nerf trijumeau. La douleur est, elle aussi, unilatérale. Deux tiers des sujets présentent des lésions cornéennes ponctiformes et/ou dendritiques. Un diagnostic rapide est impératif afin de limiter l’atteinte cornéenne et préserver la fonction visuelle. L’approche habituellement recommandée est l’initiation d’un traitement antiviral systémique afin de limiter la réplication virale ; des corticostéroïdes topiques sont conseillés afin de limiter la réponse inflammatoire et de contrôler la kératite et l’iritis. Cette approche permet de réduire la fréquence des complications ophtalmologiques de 50 à 20 %.
• La nécrose rétinienne
La nécrose rétinienne aiguë (NRA) est une rétinite nécrotique rare, mais dévastatrice. Elle est associée au VZV principalement chez la personne âgée. Une atteinte cutanée associée n’a été décrite que dans 73 % des cas et est rarement concomitante. Les patients présentent le plus souvent et en quelques jours des troubles visuels sévères associés à des douleurs ; plus rarement le début est insidieux et marqué par des symptômes visuels légers (corps flottants). Uvéite granulomateuse, inflammation du vitré et vascularite rétinienne occlusive conduisent à la perte de l’acuité visuelle et à un décollement rétinien en l’absence de traitement. À moins que le patient n’ait reçu un traitement approprié, le second œil est atteint dans un délai de 2 mois dans 33 à 50 % des cas. Dix jours d’antiviraux intraveineux avec relais oral pendant 6-12 semaines permettent d’accélérer la disparition des lésions et de réduire le risque d’atteinte du second œil. Dans les formes sévères et notamment en cas de neuropathie optique, une corticothérapie intraveineuse, dans les 24 heures suivant l’initiation des antiviraux, est recommandée. Si les lésions aiguës disparaissent généralement en 6-12 semaines, le pronostic visuel reste très médiocre, puisque dans 75 à 85 % des cas une cécité est décrite.
• Les complications neurologiques
Le syndrome de Ramsay Hunt est caractérisé par la triade : (1) paralysie faciale périphérique homolatérale, (2) douleurs auriculaires, et (3) éruption vésiculeuse dans le conduit auditif externe et sur le pavillon de l’oreille. Des troubles gustatifs, digestifs, occulaires, de l’équilibre (nausées, vomissements, nystagmus), de l’audition (acouphènes, hyperacousie) et de la lacrimation sont parfois associés. Il est consécutif à la réactivation du VZV dans le ganglion géniculé puis à une atteinte du nerf vestibulo-cochléaire avec extension aux Ve, VIIe, IXe et Xe paires de nerfs crâniens. Dans 14 % des cas, les vésicules peuvent apparaître après l’installation de la paralysie faciale périphérique, ce qui rend le diagnostic plus difficile. Le pronostic fonctionnel peut être sombre.
Dans de rares cas, le zona ophtalmique peut se compliquer d’un accident vasculaire cérébral ischémique, dans les semaines voire les mois suivant l’éruption. Cette complication est généralement précédée de céphalées intenses et d’apparition brutale et se présente sous la forme d’un hémi-syndrome moteur controlatéral à l’éruption cutanée. Les données d’autopsies ont suggéré l’hypothèse d’une invasion artérielle directe par les particules virales à partir des petits vaisseaux méningées entourant le ganglion de Gasser, favorisant la formation d’emboles multifocaux dans les branches des artères cérébrales antérieures et moyennes et/ou une vascularite granulomateuse des artères cérébrales. Le taux de mortalité avoisine 20 % et les survivants présentent le plus souvent de lourdes séquelles neurologiques
Une réaction méningée à type de pléïocytose est retrouvée dans 40 à 50 % des zonas quelle que soit la localisation. D’authentiques méningites ont été rapportées. L’encéphalite à VZV est rare chez le sujet immunocompétent mais peut survenir avant ou jusqu’à 6 mois après l’éruption. Elle complique généralement l’atteinte d’un dermatome crânien ou cervical. Elle se manifeste typiquement par un syndrome confusionnel dans les jours suivant les premières vésicules. La diffusion médullaire du VZV atteignant la corne antérieure peut se traduire par une parésie segmentaire. Contemporaine de l’éruption, elle est observée dans environ 3 % des cas et peut se compliquer d’une atrophie secondaire dans 25 % des cas. Lors d’atteintes de dermatomes thoraciques, par diffusion dans le cordon postérieur, une myélite transverse peut être également une complication rare.
Traitement
Les objectifs de la prise en charge thérapeutique sont : (1) d’accélérer la cicatrisation des lésions cutanées, (2) de contrôler la douleur associée à la névrite aiguë et (3) de réduire le risque de complications. La prescription dans les 72 premières heures d’un traitement antiviral devrait permettre de répondre à ces 3 objectifs. L’administration conjointe de corticostéroïdes n’apporte aucun bénéfice supplémentaire sur les douleurs chroniques comparativement à l’aciclovir seul. Cette association permet par contre un meilleur contrôle des douleurs aiguës et une accélération de la cicatrisation des lésions, et une réduction significative du délai de retour à un sommeil de qualité, à la reprise des activités quotidiennes et à l’arrêt des traitements antalgiques. Cependant, malgré l’exclusion des études des patients ayant des contre-indications au traitement par corticoïdes, de nombreux effets indésirables graves ont été rapportés. Au final le rapport bénéfice risque de cette association est faible. En l’absence de preuve dans la population âgée, il n’est pas recommandé d’associer un corticostéroïde au traitement antiviral à la phase aiguë, sauf dans les cas rares de nécrose rétinienne.
• Traitement antiviral
Les quatre antiviraux disponibles (aciclovir, valaciclovir, famciclovir, brivudine) ont montré leur efficacité chez les sujets immunocompétents âgés de plus de 50 ans. Le valaciclovir, pro-drogue de l’aciclovir, est la molécule recommandée. Pour des raisons de biodisponibilité, le nombre de prises quotidiennes est moindre qu’avec les autres antiviraux. Le valaciclovir a été comparé aux autres antiviraux, et a été associé à une diminution significative de la durée de la névrite aiguë et des NPZ lorsqu’elles surviennent. Plusieurs méta-analyses et études contrôlées ont montré que les traitements antiviraux systémiques réduisent de façon significative la durée et l’incidence des douleurs aiguës et chroniques. Dans une méta-analyse de 4 études randomisées contre placebo, l’aciclovir initié à la phase aiguë était associé à une antalgie plus rapide sur les douleurs relatives à la névrite aiguë (63 vs 119 jours) ; le bénéfice observé était plus important chez les patients de plus de 50 ans. Le valaciclovir semble avoir une efficacité supérieure à celle observée avec l’aciclovir (38 vs 51 jours). Dans une seconde méta-analyse comprenant une étude randomisée supplémentaire, il est retrouvé que le traitement par aciclovir réduisait de 46 % l’incidence des NPZ à 6 mois.
Diverses études européennes ont montré que le brivudine inhibe la réplication virale aussi bien, voire mieux, que l’aciclovir ou le famciclovir. Le bémol à son utilisation vient de sa haute toxicité lorsqu’elle est associée au 5-fluoro-uracile lors du traitement de patients cancéreux.
Les antiviraux doivent être administrés par voie orale dans les 72 premières heures de l’éruption ; les formes intraveineuses n’ont pas montré de supériorité. Au-delà de ce délai, l’utilité clinique des traitements n’a pas été démontrée mais peut être considérée, notamment en présence de nouvelles lésions vésiculaires. En l’absence d’étude spécifique chez la personne âgée, la précaution de prescription, en raison du risque de néphrotoxicité, est l’adaptation de la dose à la clairance de la créatinine (tableau 1).

• Prise en charge de la névralgie aiguë chez la personne âgée
 Les névralgies aiguës (NA) peuvent précéder l’éruption de quelques jours à quelques semaines. L’objectif de la prise en charge thérapeutique est non seulement de les soulager mais aussi de minimiser le risque de survenue de NPZ. Des études randomisées contrôlées évaluant spécifiquement l’efficacité des antalgiques dans le traitement des NA n’ont pas encore été publiées. Le choix du traitement antalgique dépend avant tout de l’intensité des douleurs et des comorbidités du patient (tableau 2). Les patients ayant des douleurs modérées peuvent bénéficier d’anti-inflammatoires non stéroïdiens (AINS) seuls ou en association avec un opioïde faible ou du paracétamol. Chez les sujets fragiles et/ou présentant des pathologies multiples, des précautions particulières doivent être prises dans la prescription des AINS dont l’utilisation est associée à de nombreux effets indésirables, gastro-intestinaux, cardiovasculaires et rénaux. La corticothérapie orale ne constitue pas un traitement de choix car elle ne contribue pas de façon significative à la diminution de l’intensité et de la durée des douleurs. Elle est par ailleurs grevée d’effets indésirables importants et doit être réservée aux formes ophtalmiques avec nécrose rétinienne.
Les névralgies aiguës (NA) peuvent précéder l’éruption de quelques jours à quelques semaines. L’objectif de la prise en charge thérapeutique est non seulement de les soulager mais aussi de minimiser le risque de survenue de NPZ. Des études randomisées contrôlées évaluant spécifiquement l’efficacité des antalgiques dans le traitement des NA n’ont pas encore été publiées. Le choix du traitement antalgique dépend avant tout de l’intensité des douleurs et des comorbidités du patient (tableau 2). Les patients ayant des douleurs modérées peuvent bénéficier d’anti-inflammatoires non stéroïdiens (AINS) seuls ou en association avec un opioïde faible ou du paracétamol. Chez les sujets fragiles et/ou présentant des pathologies multiples, des précautions particulières doivent être prises dans la prescription des AINS dont l’utilisation est associée à de nombreux effets indésirables, gastro-intestinaux, cardiovasculaires et rénaux. La corticothérapie orale ne constitue pas un traitement de choix car elle ne contribue pas de façon significative à la diminution de l’intensité et de la durée des douleurs. Elle est par ailleurs grevée d’effets indésirables importants et doit être réservée aux formes ophtalmiques avec nécrose rétinienne.
En cas de douleurs modérées à sévères, les opiacés sont alors recommandés. Au cours de la phase subaiguë (30 jours - 90 jours), en l’absence de contrôle des douleurs malgré un traitement opiacé bien conduit, il doit être proposé d’associer soit un agoniste des canaux calciques α2-δ (gabapentine ou prégabaline), sooit un antidépresseur de type inhibiteur sélectif de la recapture de la sérotonine et de la noradrénaline (ISRSN). Pour tous les patients dont le traitement antalgique bien conduit ne permet pas un contrôle suffisant des douleurs, un avis auprès d’un spécialiste ou d’un centre de lutte contre la douleur est préconisé. Les doses adaptées à la fonction rénales, des principaux médicaments antiviraux et antalgiques recommandés pour la prise en charge des NA, sont présentées dans le tableau 3.

• Prise en charge de la NPZ chez la personne âgée
Comme la réponse aux traitements antalgiques est très individuelle et non prévisible, une approche systématisée fondée sur des critères simples doit être utilisée (tableau 4) afin de déterminer la prise en charge pharmacologique qui apportera le meilleur effet avec le minimum d’effets indésirables. Il est important de porter une attention toute particulière aux différents facteurs associés aux NPZ qui peuvent altérer la qualité de vie des patients, comme la dépression, l’anxiété ou les troubles du sommeil.
 Les antidépresseurs tricycliques-TCA et la carbamazépine (inducteur des cytochromes P450) doivent être prescrits avec une extrême prudence en raison des interactions médicamenteuses et des effets secondaires. Dans la population âgée, les médicaments de première intention sont : (i) les antidépresseurs d’autres familles et particulièrement les ISRSN (venlafaxine, duloxétine - efficacité prouvée par plusieurs études randomisées et qui semblerait équivalente à celle des TCA) ; (ii) les agonistes des canaux calciques α2-δ (gabapentine et prégabaline) ; (iii) les anesthésiques en topique (Lidocaïne patch 5 % - Lidoderm® ou en compresse 5 % - Versatis®, ou en gel), avec une dose limite au regard de la surface cutanée à couvrir. L’effet du paracétamol et des AINS sur les douleurs neurogènes n’a jamais été démontré chez l’homme. Cependant, malgré le manque de preuves, ces médicaments restent très utilisés. En l’absence de réponse satisfaisante avec les médicaments de première ligne seuls ou en association, les opiacés (buprénorphine, hydromorphone, morphine, oxycodone, tramadol) peuvent être proposés. Les doses adaptées à la fonction rénale des principaux médicaments antalgiques recommandés dans la prise en charge des NPZ sont présentées dans le tableau 3. Les antagonistes des récepteurs N-méthyl-D-aspartate (NMDA - mémantine, dextrométorphan), les inhibiteurs sélectifs de la Cox2 (anti-Cox2), les topiques AINS, l’acupuncture et autres techniques alternatives ont été testés sans jamais montrer d’efficacité.
Les antidépresseurs tricycliques-TCA et la carbamazépine (inducteur des cytochromes P450) doivent être prescrits avec une extrême prudence en raison des interactions médicamenteuses et des effets secondaires. Dans la population âgée, les médicaments de première intention sont : (i) les antidépresseurs d’autres familles et particulièrement les ISRSN (venlafaxine, duloxétine - efficacité prouvée par plusieurs études randomisées et qui semblerait équivalente à celle des TCA) ; (ii) les agonistes des canaux calciques α2-δ (gabapentine et prégabaline) ; (iii) les anesthésiques en topique (Lidocaïne patch 5 % - Lidoderm® ou en compresse 5 % - Versatis®, ou en gel), avec une dose limite au regard de la surface cutanée à couvrir. L’effet du paracétamol et des AINS sur les douleurs neurogènes n’a jamais été démontré chez l’homme. Cependant, malgré le manque de preuves, ces médicaments restent très utilisés. En l’absence de réponse satisfaisante avec les médicaments de première ligne seuls ou en association, les opiacés (buprénorphine, hydromorphone, morphine, oxycodone, tramadol) peuvent être proposés. Les doses adaptées à la fonction rénale des principaux médicaments antalgiques recommandés dans la prise en charge des NPZ sont présentées dans le tableau 3. Les antagonistes des récepteurs N-méthyl-D-aspartate (NMDA - mémantine, dextrométorphan), les inhibiteurs sélectifs de la Cox2 (anti-Cox2), les topiques AINS, l’acupuncture et autres techniques alternatives ont été testés sans jamais montrer d’efficacité.
Peu d’études ont porté sur l’efficacité des thérapies combinées dans le traitement de la NPZ. Trois essais randomisés contrôlés ont démontré l’efficacité de la gabapentine-agonistes opioïdes (morphine, oxycodone) et de la gabapentine-nortiptyline comparativement aux molécules prises isolément chez des sujets avec une polyneuropathie diabétique ou des NPZ. Une étude de petite taille a soulevé l’intérêt d’une association gabapentine-venlafaxine versus gabapentine et placebo. De façon intéressante, la gabapentine a été combinée au VCV dès l’apparition des premières lésions vésiculeuses et l’efficacité préventive de cette association sur l’incidence des NPZ a été étudiée. Considérant 133 patients > 50 ans avec des douleurs sévères en phase aiguë, la gabapentine-VCV réduisait de 10 % l’incidence des NPZ à 6 mois comparativement au traitement antiviral seul.
En cas de NPZ réfractaires, une neurostimulation transcutanée ou des injections intrathécales de corticostéroïdes et/ou de lidocaïne peuvent être proposées. Appliquée sur la peau en dehors des zones d’allodynie, la neurostimulation permet parfois de masquer les dysesthésies. Si les injections intrathécales de corticostéroïdes apparaissent bénéfiques, elles sont par contre dangereuses. La capsaïcine percutanée (en crème avec de faibles concentrations : 0,025 % ou 0,075 % ou en patch 8 % - Qutensa®) est une autre alternative mais l’efficacité à long-terme doit encore être étudiée. Tout comme l’application de lidocaïne, l’étendue de la surface cutanée à couvrir peut être un facteur limitant. La lidocaïne est cependant une option en première intention chez la personne âgée, notamment lorsque des effets indésirables au niveau neurologique central sont redoutés avec l’utilisation des autres molécules orales. Une période d’essai de 2-4 semaines est cependant nécessaire pour juger de l’efficacité. Des injections sous-cutanées de toxine botulinique pourraient diminuer les NPZ selon les résultats d’un essai contrôlé. L’effet analgésique serait dû à une action locale directe de la toxine sur les fibres nociceptives. Une neurostimulation transcutanée par un ou plusieurs stimulateurs générateurs d’impulsions de fréquences variables (10-100 Hz) et de durées variables (10-1 000 µsec) peut être proposée.
Prévention
• Le vaccin vivant atténué sans adjuvant (Zostavax®)
 Les difficultés à traiter efficacement le zona et surtout à en prévenir les complications ont conduit à la recherche et au développement d’un programme de vaccination. Le vaccin actuellement disponible est un vaccin à virus vivant atténué sans adjuvant et se compose d’une dose unique de 0,65 ml ne contenant pas moins de 19 400 pfu (plaque-forming units) de la souche virale Oka/Merck. Il s’agit de la même souche contenue dans le vaccin contre la varicelle mais qui, lui, contient 1 350 pfu. Son efficacité protectrice, l’immunogénicité induite et la tolérance ont été évaluées à partir d’une revue systématique des essais contrôlés randomisés ou quasi-randomisés chez des adultes âgés (âge moyen > 60 ans). Huit essais randomisés incluant un total de 52 269 participants ont été identifiés et publiés dans 13 articles différents. Les cas confirmés de zona ont été moins fréquents chez les patients vaccinés que chez ceux des groupes placebo avec un risque relatif (RR) de 0,49 (intervalle de confiance - IC à 95 % : 0,43 à 0,56). Le nombre de sujets à vacciner pour éviter 1 cas était calculé à 50 et les analyses selon les groupes d’âge ont montré un plus grand avantage chez les participants de 60 ans à 69 ans (RR = 0,36 (IC à 95 % : 0,30 à 0,45) que chez les participants de 70 ans ou plus (RR = 0,63 (IC à 95 % : 0,53 à 0,75). Les effets indésirables systémiques liés au vaccin ont été plus fréquents dans le groupe vacciné (RR = 1,29 - IC 95 % : 1,05 à 1,57). Le RR de survenu d’un ou plusieurs effets indésirables au site d’injection était de 4,51 (IC 95 % : 2,35 à 8,68). Les effets indésirables étaient plus fréquents chez les personnes de 60 à 69 ans. En conclusion les auteurs considéraient que le vaccin contre le zona était efficace dans la prévention du zona. Bien que les avantages de la vaccination étaient plus importants dans le groupe d’âge le plus jeune (60 à 69 ans), ce fut également le groupe d’âge avec les événements indésirables les plus défavorables. En général, le vaccin a été bien toléré ; il induit peu d’effets indésirables systémiques et ceux observés au site d’injection étaient d’intensité légère à modérée.
Les difficultés à traiter efficacement le zona et surtout à en prévenir les complications ont conduit à la recherche et au développement d’un programme de vaccination. Le vaccin actuellement disponible est un vaccin à virus vivant atténué sans adjuvant et se compose d’une dose unique de 0,65 ml ne contenant pas moins de 19 400 pfu (plaque-forming units) de la souche virale Oka/Merck. Il s’agit de la même souche contenue dans le vaccin contre la varicelle mais qui, lui, contient 1 350 pfu. Son efficacité protectrice, l’immunogénicité induite et la tolérance ont été évaluées à partir d’une revue systématique des essais contrôlés randomisés ou quasi-randomisés chez des adultes âgés (âge moyen > 60 ans). Huit essais randomisés incluant un total de 52 269 participants ont été identifiés et publiés dans 13 articles différents. Les cas confirmés de zona ont été moins fréquents chez les patients vaccinés que chez ceux des groupes placebo avec un risque relatif (RR) de 0,49 (intervalle de confiance - IC à 95 % : 0,43 à 0,56). Le nombre de sujets à vacciner pour éviter 1 cas était calculé à 50 et les analyses selon les groupes d’âge ont montré un plus grand avantage chez les participants de 60 ans à 69 ans (RR = 0,36 (IC à 95 % : 0,30 à 0,45) que chez les participants de 70 ans ou plus (RR = 0,63 (IC à 95 % : 0,53 à 0,75). Les effets indésirables systémiques liés au vaccin ont été plus fréquents dans le groupe vacciné (RR = 1,29 - IC 95 % : 1,05 à 1,57). Le RR de survenu d’un ou plusieurs effets indésirables au site d’injection était de 4,51 (IC 95 % : 2,35 à 8,68). Les effets indésirables étaient plus fréquents chez les personnes de 60 à 69 ans. En conclusion les auteurs considéraient que le vaccin contre le zona était efficace dans la prévention du zona. Bien que les avantages de la vaccination étaient plus importants dans le groupe d’âge le plus jeune (60 à 69 ans), ce fut également le groupe d’âge avec les événements indésirables les plus défavorables. En général, le vaccin a été bien toléré ; il induit peu d’effets indésirables systémiques et ceux observés au site d’injection étaient d’intensité légère à modérée.
Plus récemment, la Short-Term Persistence Study (STPS) a fourni des données concernant la persistance de l’immunogénicité du vaccin. Ainsi, par rapport aux données initiales de la Shingles Prevention Study, l’efficacité du vaccin sur la réduction du fardeau de la maladie a diminué de 61,1 à 50,1 %, et l’effet sur l’incidence des douleurs chroniques a diminué de 66,5 à 60,1 %. L’efficacité du vaccin sur l’incidence du zona a également été réduite, passant 51,3 à 39,6 %. Bien que les différences ne fussent pas significatives, l’analyse de l’efficacité du vaccin chaque année après la vaccination pour les trois résultats a montré une diminution de l’efficacité du vaccin dès la première année. La proportion de réduction additionnelle des douleurs post-zostériennes chez les personnes âgées de 70 ans ou plus passait de 58 % la première année post-vaccinale à 45 % la seconde, 38 % la troisième et 48 % la quatrième année. En moyenne, les auteurs concluaient à une réduction moyenne de 49 % des douleurs chroniques sur quatre ans chez les patients avec un zona âgés de 70 ans ou plus. Si l’efficacité du vaccin a été également statistiquement significative pour la réduction de l’incidence du zona et du fardeau de la maladie à 5 ans, elle demeure encore incertaine au-delà. Le Haut Comité de la Santé Publique a décidé de recommander cette vaccination chez les personnes âgées de 65 à 74 ans, avec la première année de mise sur le marché un rattrapage vaccinal chez les personnes de 75 à 79 ans.
• Les perspectives d’amélioration
D’autres vaccins inactivés et sous-unitaires sont actuellement en cours de développement. Récemment, une étude de phase III du vaccin HZ/su (glycoprotéine E + AS01B ) administré en deux doses a été réalisée chez des adultes immunocompétents de 50 ans ou plus. L’efficacité vaccinale dans la prévention du zona était de 97,2 % avec une immunogénicité qui ne s’affaiblissait pas avec l’avancée en âge (96,6 % chez les 50-59 ans vs. 97,4 % entre 60 et 69 ans, et 97,9 % après 69 ans). La tolérance était bonne et similaire à celle du placebo en ce qui concerne les effets indésirables graves. La réactogénicité au niveau du site d’injection est par contre plus importante, comme cela est souvent observé avec les vaccins avec adjuvants. L’HZ/su serait également immunogène et surtout bien toléré chez les patients infectés par le VIH. Tout comme avec le vaccin vivant atténué sans adjuvant, d’autres études sont nécessaires afin de déterminer la durée de protection et l’utilité d’une dose de rappel.
Un autre vaccin atténué, appelé V212, contenant la souche Oka/Merck mais inactivé par la chaleur, est en développement. Plusieurs études cliniques sont en cours pour évaluer son efficacité et sa sécurité d’emploi, dans les populations immunodéprimées de patients notamment greffés de moelle (allogreffe ou autogreffe), de patients atteints de maladies auto-immunes ou infectés par le VIH et de patients ayant une tumeur hématologique ou solide. Dans une étude préliminaire la tolérance du vaccin était bonne quelle que soit la cause de l’immunosuppression. L’immunogénicité était satisfaisante chez les patients VIH et chez ceux ayant une tumeur, mais insuffisante chez les greffés de moelle.
Recommandation pour le traitement à la phase aiguë
• Un traitement antiviral doit être initié dans les 72 premières heures de l’éruption.
• Son effet antalgique et préventif des NPZ reste cependant modeste.
• Le recours à d’autres traitements antalgiques s’avère le plus souvent nécessaire.
• Si des recommandations ont été formulées, elles doivent être considérées avec une grande prudence chez les patients âgés, souvent fragiles, polypathologiques et polymédiqués.
Recommandation de la vaccination
Le vaccin vivant atténué sans adjuvant (Zostavax®) est disponible (65 € la dose, remboursé à 30 %).
Malgré les controverses et les incertitudes, ce vaccin diminue l’incidence du zona et des NPZ.
En termes de santé publique, cette vaccination diminue le fardeau de la maladie et a un impact pharmaco-économique favorable.
La vaccination est recommandée chez les adultes de 65 à 74 ans et bien que moins immunogénique après 70 ans, aucune dose de rappel n’a été actuellement préconisée.
Pour en savoir plus
• Recommandations pour le traitement et la prévention du zona et des douleurs associées chez la personne âgée. Lang PO, Ferahta N. Rev Med Interne. 2016 ;37:35-42.
• Les vaccins contre le zona : efficacité, sécurité, et rapport coût/bénéfices. Ferahta N, Achek I, Dubourg J, Lang PO. Press Med Press Med. 2015 Dec 24. pii : S0755 4982(15)00477-7. doi : 10.1016/j.lpm.2015.10.015. [Epub ahead of print]
• Zona des sujets âgés. Lang PO, Belmin J, Michel JP. Press Med 2009 ; 38:571-83




