L’infection gastrique à Helicobacter pylori est la plus fréquente dans le monde et la première cause infectieuse de cancer. Sa recherche et son traitement relèvent d’indications et de protocoles régulièrement actualisés, à visée curative (ulcère gastroduodénal, dyspepsie chronique, lymphome gastrique, carences en fer ou en vitamine B12, purpura thrombopénique immunologique) ou préventive de la carcinogenèse gastrique. Le traitement d’éradication repose principalement sur des trithérapies guidées par l’étude de la sensibilité aux antibiotiques.
Par le Pr Jean-Dominique de Korwin, département de Médecine interne et d’immunologie clinique, CHU Nancy, hôpitaux de Brabois-BPC Vandoeuvre-lès-Nancy
Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
Conflits d’intérêts : administrateur du Groupe d’Études Français des Helicobacter (GEFH), recevant des subventions de l’industrie pharmaceutique : Airbiopharm, Biocodex, Mayoli, Mobidiag, Orgentec, Seegene
Helicobacter pylori (H. pylori) est une bactérie à Gram négatif, découverte en 1982 par Barry Marshall et Robin Warren (prix Nobel 2005). La gastrite à H. pylori, d’évolution chronique avec ou sans atrophie muqueuse, est une maladie infectieuse [1, 2]. Les interactions entre la virulence de la bactérie, la réponse de l’hôte et les facteurs environnementaux déterminent ses caractéristiques anatomopathologiques et fonctionnelles (sécrétion acide) et le développement de pathologies principalement digestives (ulcères gastroduodénaux et néoplasies gastriques), mais dont l’expression peut être extra-digestive (déficit en fer et en vitamine B12). Une réaction à distance impliquant des processus inflammatoires et dysimmunitaires (mimétisme moléculaire…) pourrait jouer un rôle dans certaines affections en cours de démembrement [3].
C’est un domaine en constante évolution, avec une mise à jour régulière des recommandations européennes [4] et françaises, les dernières en 2017 par la HAS en lien avec le Conseil national professionnel d'hépatogastroentérologie (CNPHGE) et avec la participation des autres spécialités concernées [5-6]. Une bonne collaboration entre gastro-entérologues et médecins généralistes [7], à l’aide de fiches de liaison et des documents d’information mis à la disposition des patients (téléchargement sur le site de la HAS), devraient permettre d’optimiser la prise en charge des patients infectés.
Indications de recherche et d’éradication de H. pylori
Indications curatives
Maladies digestives
Depuis les années quatre-vingt-dix, sont fortement recommandées la recherche systématique et l’éradication de H. pylori en cas d’ulcère gastrique ou duodénal, compliqué ou non, et associé ou non à la prise d’anti-inflammatoires non stéroïdiens (AINS) ou d’aspirine. La disparition de l’infection favorise la cicatrisation et évite les récidives ulcéreuses. L’éradication est aussi impérative en cas de lymphome gastrique du MALT (mucosa associated lymphoid tissue) avec guérison de la majorité des lymphomes de bas grade et de certains lymphomes de haut grade [4, 5].
L’infection à H. pylori est une nouvelle cause de dyspepsie fonctionnelle, justifiant sa recherche systématique en cas d’endoscopie digestive haute normale [2, 4, 5].
En soins primaires, la recherche de H. pylori par méthode non invasive devant une dyspepsie chronique ne justifiant pas d’emblée une gastroscopie (âge inférieur à 45 ans, sans signe d’alarme), n’est pas indiquée en raison de la faible prévalence actuelle de l’infection en France (< 30 %), sans bénéfice démontré, et de la méconnaissance du statut de la gastrite et de la sensibilité de la bactérie aux antibiotiques [5]. En cas de symptômes digestifs hauts, la gastroscopie devrait être l’examen de première intention [5].
Maladies extra-digestives
Sont actuellement concernés les patients présentant une anémie ferriprive (correction du déficit en fer, particulièrement chez l’enfant et la femme jeune) ou un déficit en vitamine B12 inexpliqués [4, 6]. L’éradication de H. pylori a un effet bénéfique sur le purpura thrombopénique immunologique (PTI), entraînant une régres- sion de la thrombopénie dans la moitié des cas, principalement dans les formes modérées [4, 6]. Les recherches se poursuivent dans de nombreuses maladies, sans portée pratique pour l’instant [3].
| Tab. 1 : Indications curatives de la recherche et du traitement de l'infection à H. pylori | |
| Indications de recherche et d'éradication de H. pylori | Niveau de preuve |
| UGD évolutif ou non, incluant les complications | Élevé |
| Lymphome du MALT gastrique | Élevé |
| Dyspepsie chronique avec gastroscopie normale | Élevé |
| Anémie ferriptive sans cause retrouvée | Moyen |
| Carence en vitamine B12 sans cause retrouvée | Moyen |
| Purpura thrombopénique immunologique de l'adulte | Moyen |
UGD : ulcère gastrique ou duodénal ; AINS : anti-inflammatoire non stéroïdien
Indications préventives
| Tab. 2 : Indications préventives de la recherche et du traitement de l'infection à H. pylori | |
| Indication de recherche et d'éradication de H. pylori | |
| Antécédent d'UGD avec ou sans prise d'AINS ou d'aspirine à faible dose | Élevé |
| Antécédent familial de cancer gastrique au premier degré | Moyen |
| Mutation des gènes de répartition de l'ADN (syndrome de Lynch) | Moyen |
| Lésions gastriques prépéoplasiques (atrophie, métaplasie intestinale) | Moyen |
| Antécédent de résection localisée d'un cancer gastrique | Moyen |
| Chirurgie bariatrique (by-pass gastrique) | Faible |
AINS : anti-inflammatoire non stéroïdien
Maladies digestives
Le rôle éventuellement protecteur de l’infection à H. pylori vis- à-vis de certaines maladies (allergies…) reste mal évalué et sans conséquence pratique [4].
L’éradication de H. pylori est efficace chez les patients avec antécédents d’ulcère pour prévenir la récidive ulcéreuse ou la complication d’un traitement gastrotoxique ou pro-hémorragique (anticoagulants, AINS, aspirine faible dose, corticothérapie) [4, 6].
L’adénocarcinome gastrique est la deuxième cause de mortalité par cancer dans le monde et l’infection à H. pylori en est la principale cause [8]. La prévention de l’adénocarcinome gastrique par la recherche et l’éradication de H. pylori dans la population générale n'est pas recommandée en Europe [4, 6, 9]. En revanche, des patients à haut risque de développer un cancer gastrique sont actuellement identifiés [2, 4, 6], justifiant une éradication préventive de H. pylori. Il s’agit des personnes, apparentées à un patient ayant eu un cancer de l’estomac (parents, frères/soeurs, enfants), plus souvent infectées et avec un risque de cancer augmenté de 1,8 à 3,5 fois [10, 11]. Sont aussi concernés les patients, ayant un syndrome de prédisposition aux cancers digestifs (HNPCC/Lynch), ou ayant eu une gastrectomie partielle ou un traitement endoscopique de lésions cancéreuses gastriques, ou présentant des lésions prénéoplasiques gastriques (atrophie sévère et/ou métaplasie intestinale, dysplasie) (tableau 2) [2, 4, 6]. Cette mesure préventive s’applique aussi avant la chirurgie bariatrique par by-pass gastrique qui isole une partie de l’estomac ne permettant plus sa surveillance [4, 6]. Ainsi, le rôle des lésions prénéoplasiques (dysplasie, atrophieet/ou métaplasie intestinale de la muqueuse gastrique) dans le développement du cancer gastrique est confirmé en Europe [12], justifiant leur recherche lors de la gastroscopie par la pratique systématique de biopsies gastriques (deux dans l’antre, une à l’angle gastrique et deux dans le corps) [5]. À l’aide de nouvelles classifications basées sur l’atrophie (OLGA) ou la métaplasie intestinale (OLGIM), il est possible d’apprécier le risque d’apparition d’un cancer gastrique [1, 2]. Après éradication de H. pylori, une surveillance gastroscopique s’impose en raison du risque résiduel de cancer en cas de lésions prénéoplasiques avancées (métaplasie intestinale) [13], suivant des modalités définies [14].
(IPP) n’est plus une indication retenue en raison du faible niveau de preuve et de la difficulté de définir une durée de traitement exposant au risque de développement d’une atrophie gastrique [4, 6].
Le choix de la méthode diagnostique dépend du risque de développement de lésions prénéoplasiques, essentiellement influencé par l’âge (tableau 3) [5, 15].
Maladies extra-digestives
Des niveaux de preuve insuffisants ou un risque faible ne débouchent pas actuellement sur des recommandations concernant notamment l’athérothrombose coronarienne et cérébrale, l’urticaire chronique, la rosacée, la dénutrition ou les démences [3, 4, 6].
| Tab. 3 : Indications des tests diagnostiques de l'infection à H. pylori suivant la situation clinique avant traitement [5,15] | |
| Sérologie ou test respiratoire / détection antigénique des selles (non-remboursés) | Gatroscopie avec biopsies gastriques |
| Patients sans symptôme digestif < 40-45 ans, apparentés à un patient ayant eu un cancer gastrique | Patients avec symptômes digestifs hauts, notamment syndrome ulcéreux |
| Patients sans symptôme digestif <40-45 ans ayant un antécédent d’ulcère sans preuve d’éradication de H. pylori | Patients avec dyspepsie, ≥ 40-45 ans et/ou signes d’alarme (dont dysphagie, amaigrissement, anémie) |
| Patients sans symptôme digestif <40-45 ans, ayant un antécédent d’ulcère sans preuve d’éradication de H. pylori avant prise d’AINS ou d’aspirine à faible dose | Anémie ferriprive ou carence en vitamine B12 sans cause trouvée |
| Prise d’IPP ou d’antibiotiques, hémorragie ulcéreuse, atrophie muqueuse (biopsies négatives) | Patients > 40-45 ans, apparentés à un patient ayant eu un cancer gastrique |
| UGD H. pylori négatif (biopsies) | Autres facteurs de risque de cancer gastrique |
| Lymphome du MALT gastrique (biopsies négatives) | Lymphome du MALT gastrique |
Purpura thrombopénique immunologique (sans symptômes digestifs) | Intervention bariatrique prévue |
| Positivité d'un test non invasif chez un sujet sans symptôme digestif | |
Méthodes diagnostiques
Le choix, parmi les méthodes validées, est orienté par la situation clinique (tableau 3)
[4, 5, 15]. La combinaison des techniques, pour augmenter la sensibilité diagnostique, est recommandée lorsque l’éradication est impérative (ulcère compliqué, lymphome du MALT gastrique…).
Détection sur biopsiesgastriques
Elle est systématique en cas de réalisation d’une gastroscopie, reposant en routine sur l’examen anatomopathologique, qui permet également l’appréciation du risque de cancer gastrique [5].
La culture est la méthode de référence, actuellement réservée à quelques centres spécialisés [5]. L’antibiogramme permet de détecter la résistance à tous les antibiotiques.
L’amplification génique (PCR) est une méthode facile à mettre en œuvre et très sensible [5, 15]. Elle permet de détecter les mutations conférant la résistance à la clarithromycine. Son inscription à la nomenclature et son remboursement permettraient de guider d’emblée le choix du traitement.
| Epidémiologie C’est l’infection bactérienne la plus répandue, la principale cause des gastrites et la deuxième cause de mortalité par cancer (adénocarcinome gastrique) dans le monde [1, 8]. Elle s’acquiert pendant l’enfance, principalement au sein de la famille, en relation avec des conditions d’hygiène et de promiscuité défavorables, ce qui explique son déclin progressif dans les pays à haut niveau de vie, et sa persistance chez les sujets âgés et dans les populations immigrées des pays en voie de développement de première ou deuxième génération (Afrique, Maghreb, Asie…). Une fois installée, l’infection persiste toute la vie. Après éradication, le risque de réinfestation à l’âge adulte est très faible dans les pays développés. |
Méthodes globales noninvasives
Elles ne nécessitent pas la pratique d’une endoscopie, mais ont des indications différentes (tableau 3).
Le test respiratoire à l’urée 13C est le plus performant pour rechercher une infection active, mais n’est remboursé par l’assurance maladie que pour contrôler l’éradication bactérienne. Sa mise en œuvre est relativement contraignante et coûteuse (achat du kit en pharmacie et réalisation du test au laboratoire).
La détection antigénique dans les selles est aussi une technique performante, mais actuellement non prise en charge par l’assurance maladie [15].
La sérologie est la plus appropriée quand il y a un risque de faux négatifs des autres techniques (méthodes sur biopsies et test res- piratoire), en raison de la diminution de la charge bactérienne suite à un traitement récent par antibiotiques ou par IPP, ou en cas d’hémorragie gastroduodénale et d’atrophie gastrique sévère. Elle est remboursée et adaptée à un dépistage coût-efficace dans les indications particulières : patients avec antécédent d’ulcère gastroduodénal sans preuve d’éradication de H. pylori (y compris avant traitement par AINS ou aspirine faible dose), patients sans symptôme digestif âgés de moins de 40-45 ans, apparentés à un patient ayant eu un cancer gastrique, patients sans symptômes digestif présentant un PTI [5]. En revanche, elle n’est pas indiquée en contrôle d’éradication en raison de la diminution inconstante du titre des anticorps. Il convient de bien choisir le test ELISA pour garantir des performances élevées [5].
Traitements d’éradication
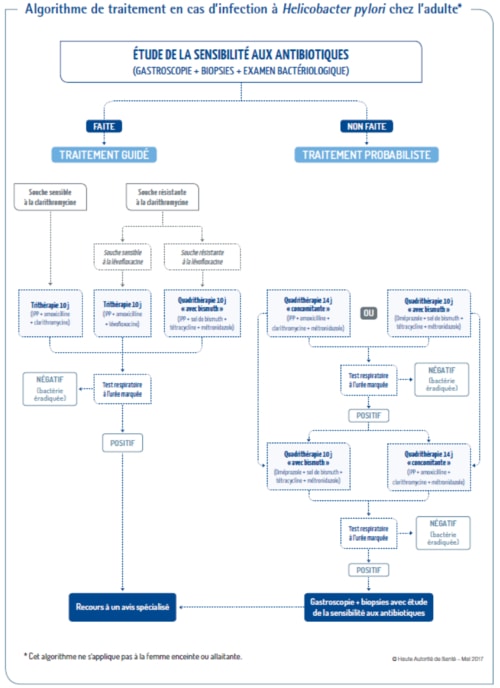
Figure 1
Il est indispensable d’avoir démontré la présence de l’infection à H. pylori avant tout traitement d’éradication. Le traitement n’est pas urgent est doit être différé en cas de grossesse ou d’allaitement [6].
Le principal facteur d’échec est la résistance aux antibiotiques, qui a nécessité une modification régulière des protocoles depuis les années 90 [6]. Elle concerne surtout la clarithromycine (résistance primaire 20-25 % en France) et la lévofloxacine (15-20 %, réservée aux traitements de recours) [4, 5]. L’autre clé du succès est une bonne observance du patient, qui peut être diminuée par le nombre de médicaments à prendre et les effets secondaires dont le patient doit être préalablement informé, car fréquents (50 %) mais nécessitant rarement l’arrêt du traitement [6].
Les points essentiels
|
Traitements de première ligne
À la fin des années 2000, les quadrithérapies probabilistes (IPP et trois agents anti-infectieux) ont supplanté les trithérapies, qui conservent leur intérêt lorsqu’elles sont guidées par la détermination préalable de la sensibilité aux antibiotiques (impérative en cas d’échecs répétés) [6].
Pour garantir un taux de succès supérieur à 90% [16], il est maintenant recommandé d’utiliser les trithérapies associant un IPP et deux antibiotiques pendant 10 jours en les adaptant à la sensibilité de la souche qui infecte le patient, notamment à la clarithromycine (fig.1) [6].
En cas de sensibilité à la clarithromycine, prescription d’une trithérapie de 10 jours associant, en 2 prises matin et soir, un IPP (pleine dose), amoxicilline (1000 mg) et clarithromycine (500 mg). En cas de résistance à la clarithromycine, prescription d’une trithérapie de 10 jours combinant aux mêmes doses un IPP et l’amoxicilline à la lévofloxacine (500 mg en une prise) si souche sensible. À défaut, prescription de la quadrithérapie « avec bismuth » pendant 10 jours (oméprazole 20 mg matin et soir et Pylera® 3 gélules quatre fois par jour combinant subcitrate de bismuth, tétracycline et métronidazole). En cas d’allergie documentée à l’amoxicilline et de souche sensible à la clarithromycine, prescription d’une trithérapie combinant un IPP et la clarithromycine au métronidazole (500 mg matin et soir). En cas d’allergie documentée à l’amoxicilline et de résistance à la clarithromycine, prescription de quadrithérapie « avec bismuth ».
En cas d’impossibilité de détermination préalable de la sensibilité aux antibiotiques, la HAS et le CNPHGE recommandent 2 lignes interchangeables de traitement probabiliste (fig.1) [6]. En première ligne, soit quadrithérapie « concomitante » de 14 jours (IPP, amoxicilline, clarithromycine, métronidazole, à même posologie qu’en trithérapie), soit la quadrithérapie « avec bismuth » de 10 jours (oméprazole et Pylera®). La quadrithérapie « avec bismuth » dispose d’une AMM européenne et son efficacité reste supérieure ou égale à 90 % [6]. Elle est à privilégier en cas de prise antérieure de macrolide ou d’allergie à l’amoxicilline. En deuxième ligne de traitement probabiliste, il ne faut pas prescrire de nouveau la quadrithérapie utilisée en 1ère ligne et vérifier l’observance, mais remplacer en cas d’échec une des 2 premières lignes de traitement par l’autre.
Les deux lignes de quadrithérapie, avec ou sans bismuth, sont interchangeables, car n’utilisant pas les mêmes antibiotiques, sauf le métronidazole dont la résistance in vitro a peu d’influence [6]. Chez un patient allergique à l’amoxicilline, prescription d’un traitement guidé par l’évaluation de la sensibilité aux antibiotiques en cas d’échec de la quadrithérapie « avec bismuth ».
Les échecs résiduels paraissent très rares, sauf problème intercurrent (observance, effets secondaires…). Après deux échecs successifs, un avis spécialisé (CNR des Campylobacters et Hélicobacters de Bordeaux ou Groupe d’Etude Français des Helicobacters : www.helicobacter.fr) s’impose avec détection de la résistance aux antibiotiques (clarithromycine, lévofloxacine, tétracycline, rifabutine) pour guider la trithérapie de recours d’une durée de 14 jours [6].
Après chaque tentative de traitement, le contrôle d’éra- dication est indispensable par test respiratoire ou examen des biopsies gastriques, au moins quatre semaines après prise d’antibiotiques et deux semaines après arrêt des IPP.
Références bibliographiques
[1] Moussata D, de Korwin JD. Gastrites EMC- gastroentérologie, 2014 [9-017-A-10] - Doi :10.1016/S1155- 1968(14)62889-3.
[2] Sugano K, Tack J, Kuipers EJ, Graham DY, El-Omar EM, Miura S, et al. ; faculty members Global Consensus Kyoto global consensus reporton Helicobacterpylori Gut 2015;64:1353-67.
[3] de Korwin JD, Ianiro G, Gibiino G, Gasbarrini A. Helicobacter pylori infection and extragastric diseases in 2017. Helicobacter 2017; 22 Suppl 1. doi: 10.1111/hel.12411.
[4] Malfertheiner P, Megraud F, O'Morain CA, Gisbert JP, Kuipers EJ, Axon AT, et al. Management of Helicobacter pylori infection - the Maastricht V/Florence Consensus Report. Gut 2017; 66(1):6-30.
[5] Fiche Pertinence des soins sur le diagnostic de l’infection par Helicobacter pylori chez l’adulte, mai 2017. https://www.has-sante.fr/upload/docs/application/pdf/2017-06/dir83/helicobacter_fiche_pertinence_diagnostic.pdf
[6] Fiche Pertinence des soins sur le traitement de l’infection par Helicobacter pylori chez l’adulte, mai 2017. https://www.has-sante.fr/upload/docs/application/pdf/2017-06/dir83/helicobacter_fiche_pertinence_traitement.pdf
[7] Heluwaert F, Lamarque D. Comment améliorer la prise en charge de l’infection à H. pylori entre gastroentérologues et médecins généralistes ? Hépato-Gastro 2015;22:551-58.
[8] de Korwin JD. Épidémiologie de l’infection à Helicobacter pylori et du cancer gastrique Rev Prat 2014;64:189-93.
[9] Ford AC, Forman D, Hunt RH, Yuan Y, et al. Helicobacter pylori eradication therapy to prevent gastric cancer in healthy asymptomatic infected individuals: systematic review and meta-analysis of randomized controlled trials. BMJ 2014;348:g3174..
[10] Rokkas T, Sechopoulos P, Pistiolas D, Margantinis G, et Helicobacter pylori infection and gastric histology in first-degree relatives gastric cancer patients: ameta-analysis.Eur J Gastroenterol Hepatol 2010;22:1128-33.
[11] Yaghoobi M, Bijarchi R, Narod Family history and the risk gastric Brit J Cancer2010;102:237-42.
[12] Song H, Ekheden IG, Zheng Z, Ericsson J, et al. Incidence of gastric cancer among patients with gastric precancerous lesions: observational cohort study in a low risk Western population. BMJ 2015;351:h3867.
[13] Chen HN, Wang Z, Li X, Zhou ZG. Helicobacter pylori eradication cannot reduce the risk gastric cancer in patients with intestinal metaplasia and dysplasia : evidence from a meta-Gastric Cancer 2016; 19:166-75.
[14] Dinis-Ribeiro M, Areia M, de Vries AC, Marcos-PintoR, et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa de Endoscopia Digestiva (SPED). Endoscopy 2012;44:74-94.
[15] HAS. Évaluation des actes de biologie médicale relatifs à la prise en charge de l’infection à Helicobacter pylori. Février 2019. https://www.has-sante.fr/jcms/c_2863243/fr/evaluation-des-actes-de-biologie-medicale-relatifs-a-la-prise-en-charge-de-l-infection-a-helicobacter-pylori.
[16] Martos M, Bujanda L, Salicio Y, Sarasqueta C, Ibarra B, Mendarte U, et al. Clarithromycin for first-line treatment of Helicobacter pylori infection after culture in high-resistance regions. Eur J Gastroenterol Hepatol 2014; 26:1380-4.
- par Pr Jean-Dominique de Korwin (rééd. article "Tout Prévoir" N°449 mars 2014




